Este Introduce la idea de la discontinuidad de la materia, es decir, es la primera teoría científica que considera que la materia está dividida en átomos. Los postulados básicos de esta teoría son:
- La materia está dividida en unas partículas indivisibles e inalterables llamadas átomos.
- Los átomos son partículas muy pequeñas y no se pueden ver a simple vista.
- Todos los átomos de un mismo elemento son iguales entre sí, igual masa e iguales propiedades.
- Los átomos de distintos elementos tienen distinta masa y distintas propiedades.
- Los compuestos se forman cuando los átomos se unen entre sí, en una relación constante y sencilla.
- En las reacciones químicas los átomos se separan o se unen; pero ningún átomo se crea ni se destruye, y ningún átomo de un elemento se convierte en átomo de otro elemento.
- Esta concepción se mantuvo casi durante un siglo

Posteriormente, en el año 1897 se descubre el electrón, una de las partículas subatómicas que conforma el átomo. En 1898 Thomson propuso un modelo atómico que tomaba en cuenta la existencia de dicha partícula subatómica. Su modelo era estático, ya que suponía que los electrones estaban en reposo dentro del átomo, y que el conjunto era eléctricamente neutro.
El modelo de Thomson era parecido a un pastel de frutas: los electrones estaban incrustados en una masa esférica de carga positiva. La carga negativa total de los electrones era la misma que la carga total positiva de la esfera, por lo que dedujo que el átomo era neutro.
Thomson también explicó la formación de iones, tanto positivos como negativos.
Cuando el átomo pierde algún electrón, la estructura queda positiva y se forman iones positivos; pero si el átomo gana algún electrón, la estructura queda negativa y se forman iones negativos.

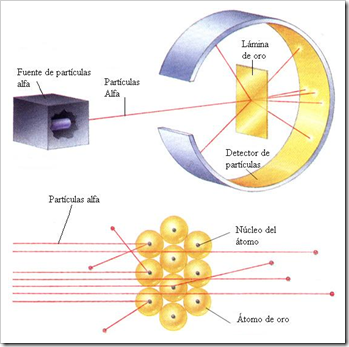
En 1911, Rutherford empleó las partículas alfa para determinar la estructura interna de la materia. A partir de ese experimento dedujo que:
- La mayoría de las partículas atraviesan la lámina sin desviarse (99,9%).
- Algunas partículas se desvían (0,1%).
- Núcleo: aquí se concentra casi la totalidad de la masa del átomo, y tiene carga positiva.
- Corteza: está formada por los electrones, que giran alrededor del núcleo describiendo órbitas circulares (sistema solar en miniatura)
Así mismo, también dijo que la materia es neutra, ya que la carga positiva del núcleo y la negativa de la corteza se neutralizan entre sí.
Rutherford dedujo que:
- La materia está casi vacía; el núcleo es 100.000 veces más pequeño que el radio del átomo.
- La mayoría de las partículas alfa no se desvían porque pasan por la corteza, y no por el núcleo.
- Las que pasan cerca del núcleo se desvían porque son repelidas.
- Cuando el átomo suelta electrones, el átomo se queda con carga negativa, convirtiéndose en un ión negativo; pero si, por el contrario, el átomo gana electrones, la estructura será positiva y el átomo se convertirá en un ión negativo.
- El átomo es estable.

- El átomo está cuantizado, ya que solo puede poseer unas pocas y determinadas energías.
- El electrón gira en unas órbitas circulares alrededor del núcleo, y cada órbita es un estado estacionario que va asociado a un numero natural, "n" (núm. cuántico principal), y toma valores del 1 al 7.
- Así mismo, cada nivel "n" está formado por distintos subniveles, "l". Y a su vez, éstos se desdoblan en otros (efecto Zeeman), "m". Y por último, hay un cuarto núm. cuántico que se refiere al sentido, "s".
- Los niveles de energía permitidos son múltiplos de la constante de planck.
- Cuando un electrón pasa de un nivel de energía a otro, se absorbe o se emite energía. Cuando el electrón está en n=1 se dice que está en el nivel fundamental (nivel de mínima energía); al cambiar de nivel el electrón absorbe energía y pasa a llamarse electrón excitado.
- Böhr situó a los electrones en lugares exactos del espacio.
- Es el modelo planetario de Böhr.
Es el modelo actual; fue expuesto en 1925 por Heisenberg y Schrödinger.

Aspectos característicos:
Dualidad onda-partícula: Broglie propuso que las partículas materiales tienen propiedades ondulatorias, y que toda partícula en movimiento lleva una onda asociada.
Principio de indeterminación: Heisenberg dijo que era imposible situar a un electrón en un punto exacto del espacio.
Las ecuaciones del modelo mecano-cuántico describen el comportamiento de los electrones dentro del átomo, y recogen su carácter ondulatorio y la imposibilidad de predecir sus trayectorias exactas.
Así establecieron el concepto de orbital, región del espacio del átomo donde la probabilidad de encontrar un electrón es muy grande.
Características de los orbitales:
- La energía está cuantizada.
- Lo que marca la diferencia con el modelo de Böhr es que este modelo no determina la posición exacta del electrón, sino la mayor o menor probabilidad.
- Dentro del átomo, el electrón se interpreta como una nube de carga negativa, y dentro de esta nube, en el lugar en el que la densidad sea mayor, la probabilidad de encontrar un electrón también será mayor.
- El comportamiento de los electrones dentro del átomo se describe a través de los números cuánticos
- Los números cuánticos se encargan del comportamiento de los electrones, y la configuración electrónica de su distribución.
- Y por último, dada la cantidad de elementos, se necesitaba una clasificación. Hoy en día se utiliza la Tabla Periódica, aunque le precedieron muchos otras propuestas. En la Tabla Periódica los elementos se clasifican según el número atómico.
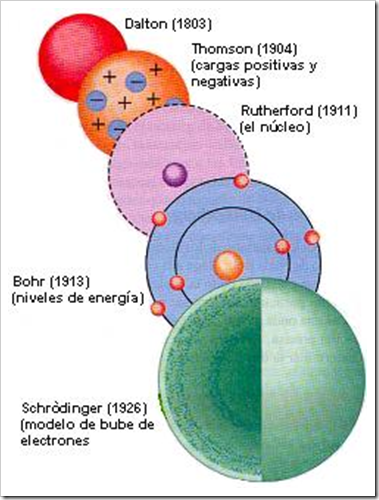
Los Modelos Atómicos





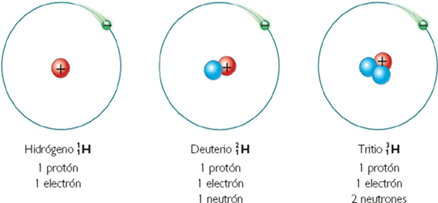



 El modelo de Rutherford de la estructura atómica dejaba un importante problema sin resolver. Se sabía que el hidrógeno, el átomo más sencillo, contenía solamente un protón, y que el átomo de helio contenía dos protones. Por tanto, la relación entre la masa de un átomo de helio y un átomo de hidrógeno debería ser 2:1. (Debido a que los electrones son mucho más ligeros que los protones, se puede ignorar su contribución a la masa atómica.) Sin embargo, en realidad la relación es 4:1.
El modelo de Rutherford de la estructura atómica dejaba un importante problema sin resolver. Se sabía que el hidrógeno, el átomo más sencillo, contenía solamente un protón, y que el átomo de helio contenía dos protones. Por tanto, la relación entre la masa de un átomo de helio y un átomo de hidrógeno debería ser 2:1. (Debido a que los electrones son mucho más ligeros que los protones, se puede ignorar su contribución a la masa atómica.) Sin embargo, en realidad la relación es 4:1. 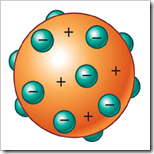

 AI igual que los rayos X, los rayos provenientes de los compuestos de uranio resultaban altamente energéticos y no los desviaba un imán, pero diferían de los rayos X en que se emitían de manera espontánea. Marie Curie, discípula de Becquerel, sugirió el nombre de radiactividad para describir la emisión espontánea de partículas y/o radiación. Desde entonces se dice que un elemento es radiactivo si emite radiación de manera espontánea.
AI igual que los rayos X, los rayos provenientes de los compuestos de uranio resultaban altamente energéticos y no los desviaba un imán, pero diferían de los rayos X en que se emitían de manera espontánea. Marie Curie, discípula de Becquerel, sugirió el nombre de radiactividad para describir la emisión espontánea de partículas y/o radiación. Desde entonces se dice que un elemento es radiactivo si emite radiación de manera espontánea. 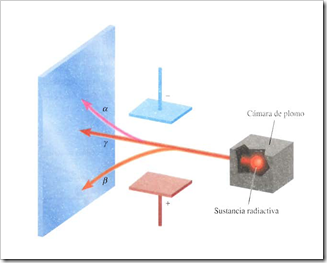

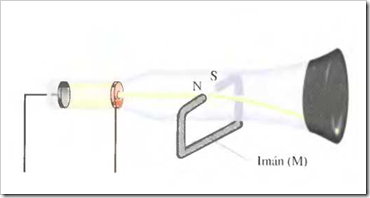
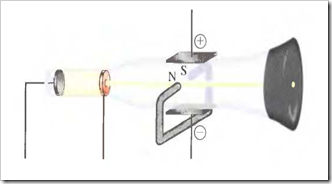
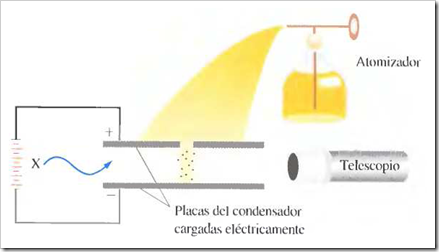
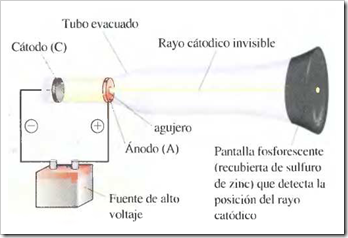 Un tubo de rayos catódicos se compone de una fuente de electricidad de alto voltaje que crea una carga negativa sobre el electrodo de la izquierda (cátodo) y una carga positiva sobre el electrodo de la derecha (ánodo). Los rayos catódicos se dirigen desde el cátodo (C) hacia el ánodo (A) que está perforado para permitir el paso de un haz estrecho de rayos catódicos. Los rayos solamente son visibles mediante el color verde fluorescente que producen sobre una pantalla recubierta de sulfuro de zinc. Son invisibles en el resto del tubo.
Un tubo de rayos catódicos se compone de una fuente de electricidad de alto voltaje que crea una carga negativa sobre el electrodo de la izquierda (cátodo) y una carga positiva sobre el electrodo de la derecha (ánodo). Los rayos catódicos se dirigen desde el cátodo (C) hacia el ánodo (A) que está perforado para permitir el paso de un haz estrecho de rayos catódicos. Los rayos solamente son visibles mediante el color verde fluorescente que producen sobre una pantalla recubierta de sulfuro de zinc. Son invisibles en el resto del tubo.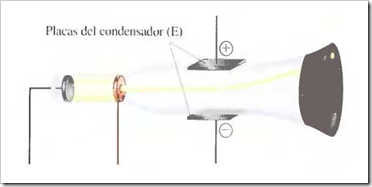


 En el siglo V A.C el filosofo griego Demócrito expresó la idea de que toda la materia estaba formada por muchas partículas pequeñas e indivisibles que llamó átomos (que significa indestructible o indivisible). A pesar de que la idea de Demócrito no fue aceptada por muchos de sus contemporáneos (entre ellos. Platón y Aristóteles), ésta se mantuvo. Las evidencias experimentales de algunas investigaciones científicas apoyaron el concepto del "atomismo", lo que condujo, de manera gradual, a las definiciones modernas de elementos y compuestos. En 1808, un científico inglés, el profesor John Dalton, formulo una definición precisa de las unidades indivisibles con las que está formada la materia y que llamamos átomos.
En el siglo V A.C el filosofo griego Demócrito expresó la idea de que toda la materia estaba formada por muchas partículas pequeñas e indivisibles que llamó átomos (que significa indestructible o indivisible). A pesar de que la idea de Demócrito no fue aceptada por muchos de sus contemporáneos (entre ellos. Platón y Aristóteles), ésta se mantuvo. Las evidencias experimentales de algunas investigaciones científicas apoyaron el concepto del "atomismo", lo que condujo, de manera gradual, a las definiciones modernas de elementos y compuestos. En 1808, un científico inglés, el profesor John Dalton, formulo una definición precisa de las unidades indivisibles con las que está formada la materia y que llamamos átomos. 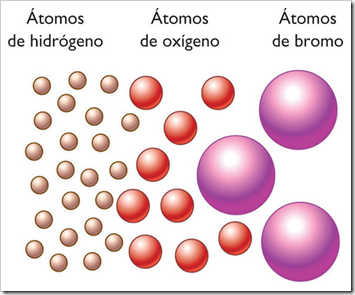
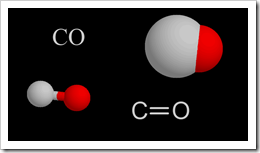
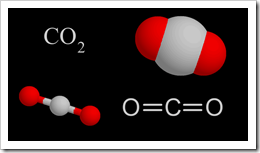
 En 1799. Joseph Proust (1754-1826) estableció que "Cien libras de cobre, disuelto en ácido sulfúrico o nítrico y precipitado por carbonato de sodio o potasio, producen invariablemente 180 libras de carbonato de color verde." *.*Esta observación y otras similares constituyeron la base de la Ley de Proust, o la Ley de las proporciones definidas:
En 1799. Joseph Proust (1754-1826) estableció que "Cien libras de cobre, disuelto en ácido sulfúrico o nítrico y precipitado por carbonato de sodio o potasio, producen invariablemente 180 libras de carbonato de color verde." *.*Esta observación y otras similares constituyeron la base de la Ley de Proust, o la Ley de las proporciones definidas: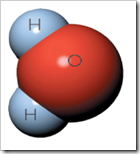 Para ver cómo se cumple la Ley de Proust, considere el compuesto agua. El agua contiene dos átomos de hidrógeno (H) por cada átomo de oxígeno (O), un hecho que puede representarse simbólicamente por una fórmula química, la conocida fórmula H2O. Las dos muestras descritas a continuación tienen las mismas proporciones de los dos elementos, expresadas como porcentajes en masa. Por ejemplo, para determinar el porcentaje en masa de hidrógeno, simplemente se divide la masa de hidrógeno por la masa de la muestra y se multiplica por 100. En cada muestra se obtendrá el mismo resultado: 11,9 por ciento de H.
Para ver cómo se cumple la Ley de Proust, considere el compuesto agua. El agua contiene dos átomos de hidrógeno (H) por cada átomo de oxígeno (O), un hecho que puede representarse simbólicamente por una fórmula química, la conocida fórmula H2O. Las dos muestras descritas a continuación tienen las mismas proporciones de los dos elementos, expresadas como porcentajes en masa. Por ejemplo, para determinar el porcentaje en masa de hidrógeno, simplemente se divide la masa de hidrógeno por la masa de la muestra y se multiplica por 100. En cada muestra se obtendrá el mismo resultado: 11,9 por ciento de H.
 En 1774, Antoine Lavoisier (1743-1794) realizó un experimento calentando un recipiente de vidrio cerrado que contenía una muestra de estaño y aire. Encontró que la masa antes del calentamiento (recipiente de vidrio + estaño + aire) y después del calentamiento (recipiente de vidrio + "estaño calentado" + el resto de aire), era la misma. Mediante experimentos posteriores demostró que el producto de la reacción, estaño calentado (óxido de estaño), consistía en el estaño original junto con parte del aire. Experimentos como este demostraron a Lavoisier que el oxígeno del aire es esencial para la combustión y le llevaron a formular la ley de conservación de la masa:
En 1774, Antoine Lavoisier (1743-1794) realizó un experimento calentando un recipiente de vidrio cerrado que contenía una muestra de estaño y aire. Encontró que la masa antes del calentamiento (recipiente de vidrio + estaño + aire) y después del calentamiento (recipiente de vidrio + "estaño calentado" + el resto de aire), era la misma. Mediante experimentos posteriores demostró que el producto de la reacción, estaño calentado (óxido de estaño), consistía en el estaño original junto con parte del aire. Experimentos como este demostraron a Lavoisier que el oxígeno del aire es esencial para la combustión y le llevaron a formular la ley de conservación de la masa: